Amyloid-Antikörper-Therapie
Information für zuweisende Ärzt:innen
Amyloid-Antikörper-Therapie (AAT) bei früher Alzheimer-Erkrankung
Seit kurzem stehen die Therapien mit Amyloid-Antikörpern für die Behandlung der Frühform der Alzheimer-Krankheit zur Verfügung (Lecanemab (Leqembi®) und Donanemab (Kisunla®) ab Anfang 11/2025). Um diese neue Behandlungsoption den hierfür geeigneten Patient:innen anbieten zu können und unsere gemeinsamen Ressourcen optimal zu nutzen, möchten wir Sie über die wichtigen Punkte zur Zuweisung, Patient:innenauswahl und Therapiebedingungen informieren.
Hintergrund und Wirksamkeit
Amyloid-Antikörper (z. B. Lecanemab, Donanemab) sind monoklonale Antikörper, die an Amyloid-β binden und zum Abbau der Amyloidablagerungen im Gehirn führen. In den zugrundeliegenden Studien zeigte sich nach 18 Monaten eine rund 30% geringere Verschlechterung kognitiver und funktioneller Leistungen gegenüber Placebo. Diese Therapien sind also krankheitsmodifizierend, d.h. sie verlangsamt den Krankheitsprozess in der Frühphase, können ihn aber nicht stoppen.
Sicherheit und Nebenwirkungen
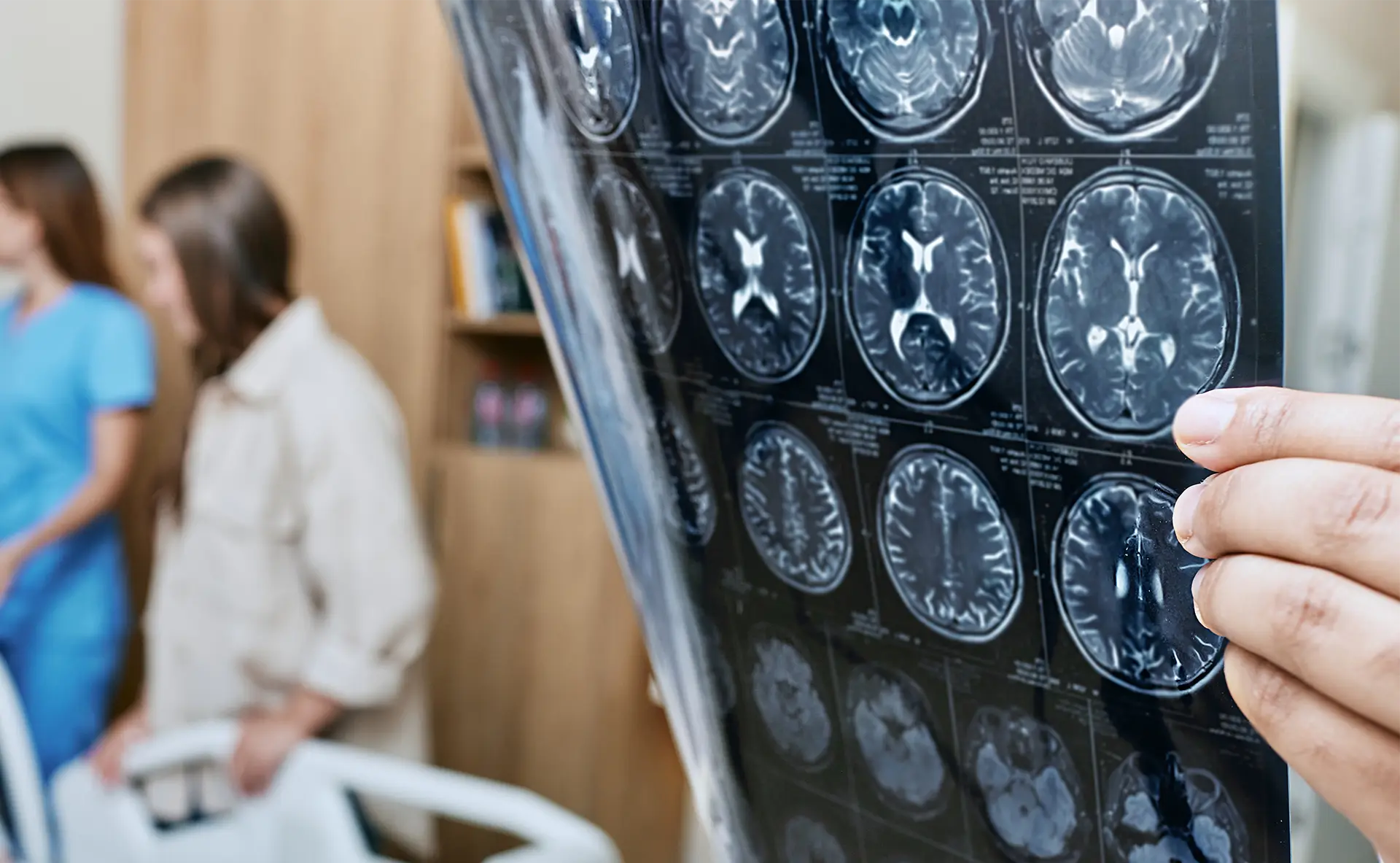
Während der Behandlung kann es neben Infusionsreaktionen (ca. 15-25%, meist mild-moderat) zu sogenannten Amyloid-Related Imaging Abnormalities (ARIA) kommen, die im MRT nachweisbar sind:
- ARIA-E: Ödeme (vasogenes Hirnödem)
- ARIA-H: Mikroblutungen oder oberflächliche Siderose, sehr selten Makroblutungen
Ein wichtiger Risikofaktor ist das Vorhandensein des Apolipoprotein-E4 (ApoE4)-Allels.
In ca. 3-6 % führen ARIAs, abhängig von ihrer Lokalisation, zu Symptomen (wie Kopfschmerzen, Verwirrtheit, Schwindel, Übelkeit, Gang-, Sehstörung, sehr selten zu Krampanfällen/Status epilepticus, Enzephalopathie). Diese Veränderungen müssen daher engmaschig klinisch und radiologisch überwacht werden und führen je nach Ausprägung zu einer Therapiepause oder zum Abbruch. Nach Unterbrechung bzw. Beendigung bilden sich diese (v.a. ARIA-E) meist vollständig zurück.
MRT-Kontrollen erforderlich:
- vor Therapiebeginn (≤ 6 Monate alt) und
- vor der 3., 5., 7. und 14. (Lecanemab) sowie danach jährlich bzw.
- vor der 2., 3., 4., 7. Und 12. Infusion (Donanemab)
Zugelassene Patient:innenpopulation
Die Amyloid-Antikörper sind für eine eng definierte Patient:innengruppe zugelassen:
- Frühes Stadium der Alzheimer-Erkrankung (leichte Demenz oder leichte kognitive Störung (mild cognitive impairment (MCI)) aufgrund einer Alzheimer-Krankheit), d.h.
- MMSE ≥ 22 oder Äquivalent
- Nachweis einer Alzheimer-Pathologie durch Liquor oder Amyloid-PET
- Aktuelles (≤ 6 Monate) MRT des Gehirns nach AAT-Protokoll vor Therapiebeginn (zum Ausschluss von Kontraindikationen, insbes. CAA-assoziierte Veränderungen (s.u.))
- ApoE4-Genotyp: heterozygot (z. B. 3/4) oder kein Träger (z. B. 3/3)
- Einwilligungsfähigkeit für medizinische Entscheidungen
- Begleitperson zur und während der Therapie
Ausschlusskriterien
Die folgende Liste orientiert sich an den Studiendaten und der klinischen Erfahrung:
- Fortgeschrittene Demenz (mittelschwer – schwer) bei Alzheimer-Krankheit
- Kognitive Beeinträchtigung nicht primär durch Alzheimer bedingt
- ApoE4-Homozygotie (ApoE 4/4)
- Orale Antikoagulation (Marcumar, DOACs)
- Zustand nach Hirnblutung oder großem Territorialinfarkt
- Pathologische MRT-Befunde:
- ≥ 4 Mikroblutungen
- ≥ 1 zerebrale Blutungen (> 10 mm)
- Superfizielle Siderose
- > 2 lakunäre Infarkte oder großer, älterer Territorialinfarkt (ACM, ACA, ACP)
- Deutliche subkortikale Hyperintensitäten (Fazekas 3)
- Ischämischer Insult oder TIA in den letzten 12 Monaten
- Epilepsie
- Schwere systemische rheumatologische Erkrankungen oder Therapie mit Immunsuppressiva, Immunglobulinen oder anderen monoklonalen Antikörpern
- Thrombopenie (< 50 G/L), INR > 1.5, unkontrollierte Blutungsneigung
- Andere, schwerwiegende Erkrankungen, insbes. unkontrollierter Bluthochdruck
- Kontraindikationen für MRT-Untersuchungen
- Bei monogenetischen Alzheimer-Formen oder Trisomie 21 angesichts der hohen Tau-Last Zurückhaltung, Studien ausstehend)
Ein Teil dieser Kriterien wird ggf. erst im Rahmen der Evaluierung in unserer Ambulanz überprüft.
Kriterien für die Zuweisung
Bitte weisen Sie Patient:innen mit folgenden Merkmalen zu und lassen Sie uns die Befunde bitte im Voraus zukommen:
- Milde Demenz oder leichte kognitive Störung (MCI) bei nachgewiesener Alzheimer-Krankheit
» bitte Originalbefunde von Neurodestruktionsmarkern im Liquor (mit Referenzwerten) und/oder Amyloid-PET-Untersuchung - MMSE 22–30 oder Äquivalent (z.B. MoCA)
- Kein Vorliegen oben genannter Ausschlusskriterien
- Letztes MRT, das keine der genannten Ausschlussbefunde zeigen sollte; falls älter als 6 Monate, werden wir ein neues MR nach AAT-Protokoll veranlassen. Bitte daher aktuell kein neues MRT durchführen, da idealerweise alle MRTs vor und während der AAT am gleichen Scanner in einer hiermit erfahrenen Radiologie durchgeführt werden sollten (1,5-, besser 3T-Scanner)
- Aktueller Medikamentenplan
- Liste der Vorerkrankungen, insbes. der Gefäßrisikofaktoren
Falls die formalen Voraussetzungen erfüllt sind, erfolgt bei uns die weitere diagnostische und ggf. APOE-Genotypisierung, sofern noch nicht durch Sie erfolgt) Abklärung sowie die Entscheidung über die mögliche Therapieeinleitung.
Rahmenbedingungen der Therapie
Bei Eignung für die Therapie ist es wichtig, dass Ihre Patient:innen über die
Rahmenbedingungen informiert und einverstanden sind:
- Intravenöse Verabreichung ambulant in unserem Transfusionszentrum, Infusionsdauer etwa 30-60 Minuten, Nachbeobachtung anfangs 2-3 Stunden, in Folge bei guter Verträglichkeit kürzer
- Therapieintervall: alle 2 (Lecanemab) bis 4 (Donanemab) Wochen
- Regelmäßige MRT-Kontrollen: mindestens 4 MRTs im ersten Behandlungsjahr (s.o.)
- 6-monatige Verlaufskontrollen zur Überwachung von Gedächtnisleistung und Allgemeinzustand
- Therapiedauer: initial über 12-18 Monate, abhängig von Produkt, klinischem Verlauf und Verträglichkeit
- Wichtige Voraussetzung: zuverlässige Begleitperson zur Unterstützung während der gesamten Therapie
Kontakt
Termine, Folgerezepte und Auskunft erhalten Sie über unser Kontaktformular
